
科目: 来源: 题型:解答题
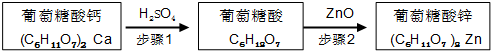
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
 请回答下列问题:
请回答下列问题: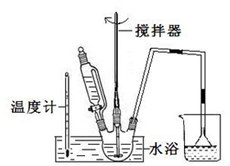
查看答案和解析>>
科目: 来源: 题型:解答题
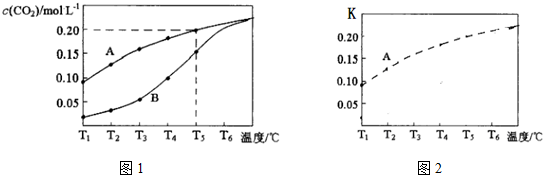
查看答案和解析>>
科目: 来源: 题型:解答题
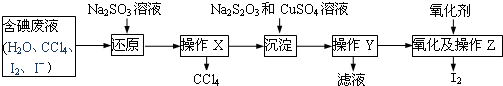
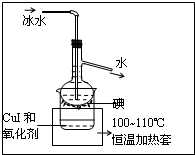
查看答案和解析>>
科目: 来源: 题型:解答题
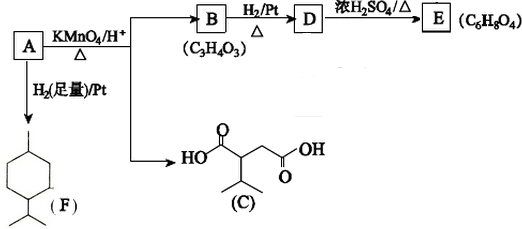
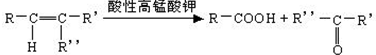
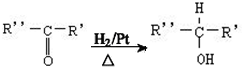
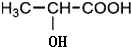 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$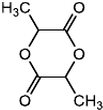 +2H2O.
+2H2O. ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).查看答案和解析>>
科目: 来源: 题型:选择题
| $\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$ | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7的血液中,c(HCO3-)=c(H2CO3) | |
| B. | 正常体温下人体发生碱中毒时,c(H+)•c(OH-)变大 | |
| C. | 人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | |
| D. | $\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=20.0时,H2CO3的电离程度大于HCO3-的水解程度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 按照系统命名法,烃分子 的名称为2,3-二甲基-3-乙基戊烷 的名称为2,3-二甲基-3-乙基戊烷 | |
| B. | 鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出 | |
| C. | 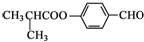 可发生加成反应、取代反应、氧化反应 可发生加成反应、取代反应、氧化反应 | |
| D. | 有机物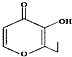 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | B的氢化物和E的氢化物能相互反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 金属D能在A的最高价氧化物中燃烧,生成A的化合物 | |
| D. | E单质的水溶液使紫色石蕊试液先变红后褪色,说明E单质具有漂白性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| B. | 探究“影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,有固定的熔点、沸点 | |
| C. | 2014年诺贝尔化学奖授予美国科学家埃里克•贝齐格、威廉•莫纳和德国科学家斯特凡•黑尔,以表彰他们为发展超分辨率荧光显微镜所作的贡献,他们的研究允许了人类观察病毒以至细胞内的蛋白质 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com