
科目: 来源: 题型:选择题
| A. | 如果盐酸的浓度是醋酸的两倍,则盐酸中的H+浓度也是醋酸中的两倍 | |
| B. | 将NaOH溶液和氨水各稀释一份,两者的OH-浓度均减小到原来的$\frac{1}{2}$ | |
| C. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| D. | 若电解质溶液的导电能力也可能比强电解质溶液的强 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| B. | PH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 新鲜的空气中:SO2、NO、N2、NH3 | |
| D. | 所有氯气的集气瓶中:H2S、H2、HCl |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
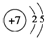 ;
;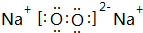 ;
;查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 2个-CH3,能生成4种一氯代物 | B. | 3个-CH3,能生成4种一氯代物 | ||
| C. | 3个-CH3,能生成5种一氯代物 | D. | 4个-CH3,能生成4种一氯代物 |
查看答案和解析>>
科目: 来源: 题型:解答题
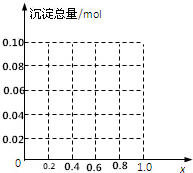 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(H+)=c(CH3CO0-) | |
| B. | 加水稀释时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈酸性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com