
科目: 来源: 题型:选择题
| A. | 氢气在氯气中燃烧生成黄绿色烟雾 | |
| B. | 红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒 | |
| C. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
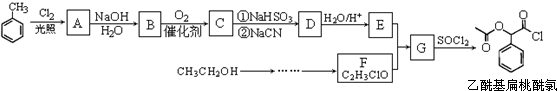
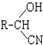 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′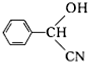 ,E中含氧官能团的名称醇羟基和羧基.
,E中含氧官能团的名称醇羟基和羧基.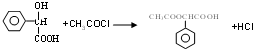 .
.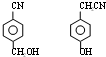 .
.查看答案和解析>>
科目: 来源: 题型:解答题
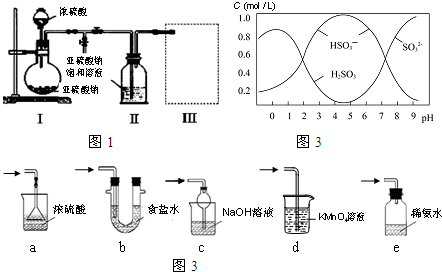
查看答案和解析>>
科目: 来源: 题型:解答题
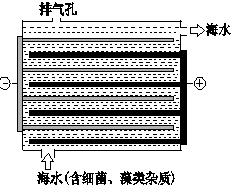 海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.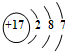 ,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).
,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
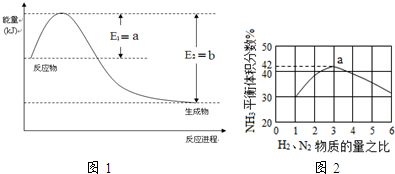
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 该物质为离子晶体 | |
| B. | 该物质可用通过C60吸附N2而制得 | |
| C. | C(N3)4中碳元素为正价 | |
| D. | 18g该物质完全分解可以产生13.44升(标准状况)氮气 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | HCO3-一定不能大量存在 | B. | pH一定是12 | ||
| C. | 加入铝片一定能产生氢气 | D. | 一定不是NH4Cl溶液 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 离子半径的大小:Na+>N3->H- | |
| B. | 它们与水发生的反应均属于氧化还原反应 | |
| C. | 两种化合物均只含离子键,不含共价键 | |
| D. | 两固体混合物溶于足量盐酸中可得到三种盐 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | V L该气体的质量(以g为单位) | B. | 1 L该气体的质量(以g为单位) | ||
| C. | 1 mol该气体的体积(以L为单位) | D. | 1 L该气体的物质的量(以mol为单位) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com