
科目: 来源: 题型:选择题
| A. | 浓硫酸和浓硝酸均具有强氧化性 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分别放在炒锅中加热,观察是否有残留物 | |
| B. | 分别用干净铁丝蘸取样品在燃气炉的火焰上灼烧,观察火焰颜色 | |
| C. | 在水杯中各盛少许相同质量的样品,分别加入足量的水,观察样品是否溶解 | |
| D. | 在水杯中各盛少许相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Si可用于制作计算机芯片,也是光导纤维的主要成分 | |
| B. | “硅胶”可用作袋装食品和瓶装药品的干燥剂,也可用作催化剂的载体 | |
| C. | 硅酸钠可用于制备木材防火剂 | |
| D. | 用碳酸氢钠可以焙制糕点、面包 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将水倒入浓硫酸中配制稀硫酸 | |
| B. | 金属钠着火,立即用泡沫灭火器灭火 | |
| C. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 | |
| D. | 皮肤上不慎沾上浓NaOH溶液,立即用盐酸冲洗 |
查看答案和解析>>
科目: 来源: 题型:填空题
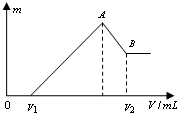 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目: 来源: 题型:填空题
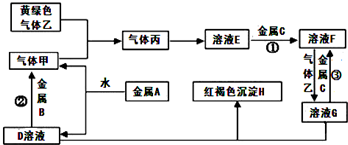 有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁溶解,析出0.01molAg和0.005 molCu | |
| B. | 铁溶解,析出0.01molAg并放出H2 | |
| C. | 铁溶解,析出0.01molAg,溶液中不再有Fe3+ | |
| D. | 铁溶解,析出0.01molAg,溶液中不再有Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com