
科目: 来源: 题型:解答题
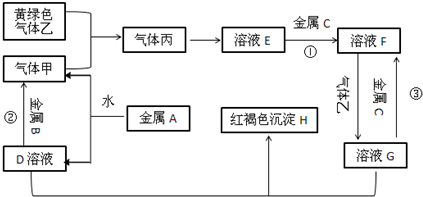
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1:6 | B. | 1:1:4 | C. | 2:1:6 | D. | 2:1:4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{4}{100+2.3}$×100% | B. | $\frac{2.3}{100+2.3-1.8}$×100% | ||
| C. | $\frac{2.3}{100+4}×100%$ | D. | $\frac{4}{100+2.3-0.1}$×100% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的钠保存在煤油中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 16g氧气中所含的氧原子数为NA | |
| B. | 1molCl2与足量H2O反应,转移的电子数为2NA | |
| C. | 标准状况下,22.4L二氧化硅所含有的原子数目为3NA | |
| D. | 钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA |
查看答案和解析>>
科目: 来源: 题型:填空题
 .氧化剂为KClO3,浓盐酸的作用酸性、还原性.
.氧化剂为KClO3,浓盐酸的作用酸性、还原性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com