
科目: 来源: 题型:选择题
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 推广燃煤发电,停建核电站,以防核泄漏事故发生 | |
| C. | 设计绿色化工工艺,提高反应的选择性和原子利用率 | |
| D. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | P H=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目: 来源: 题型:解答题
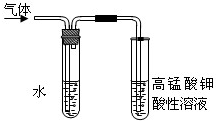 实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:
实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
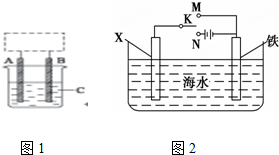 (I)研究CO2的利用对促进低碳社会的构建具有重要的意义.将CO2与焦炭作用生成CO,CO可用于炼铁等.
(I)研究CO2的利用对促进低碳社会的构建具有重要的意义.将CO2与焦炭作用生成CO,CO可用于炼铁等.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 2-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有乙烷 | D. | 一定有甲烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | C(CH3)4 | D. | CH3CH(CH3)CH2CH3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com