
科目: 来源: 题型:填空题
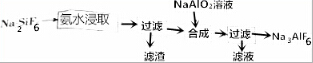
查看答案和解析>>
科目: 来源: 题型:解答题
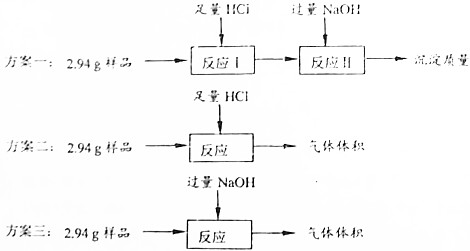
查看答案和解析>>
科目: 来源: 题型:解答题

| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 向氯水中加入淀粉KI溶液 | 溶液变蓝 | 氯水中含有氯气分子 |
| Ⅱ | 将氯水滴入AgNO3溶液 | 产生白色沉淀 | 氯气与水反应的产物中含有Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.4g | B. | 3.6g | C. | 4.8g | D. | 6.0g |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 若HnAOm是强酸,则HnBOm也一定为强酸 | |
| B. | 若一定条件下,金属A的单质能与水反应,则B的单质也一定能与水反应 | |
| C. | 常温下,若B的氢化物是气体,则A的氢化物也一定是气体 | |
| D. | A的单质可能从B的化合物中置换出B |
查看答案和解析>>
科目: 来源: 题型:解答题
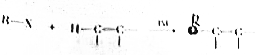
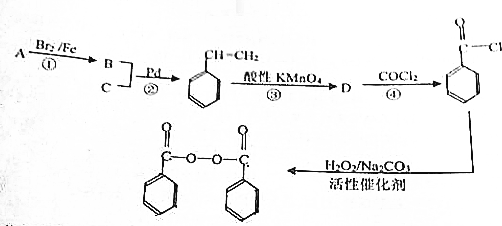
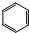 ,物质D中含有的官能团的名称为羧基.
,物质D中含有的官能团的名称为羧基.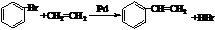 ;
;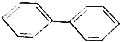 );
);查看答案和解析>>
科目: 来源: 题型:解答题
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
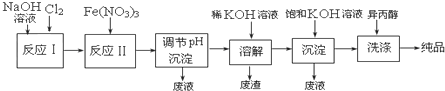
查看答案和解析>>
科目: 来源: 题型:解答题
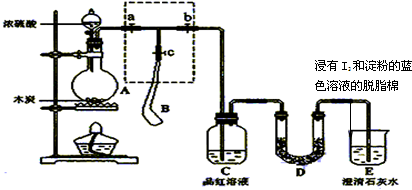
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com