
科目: 来源: 题型:解答题
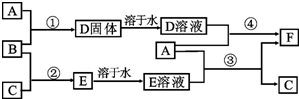 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
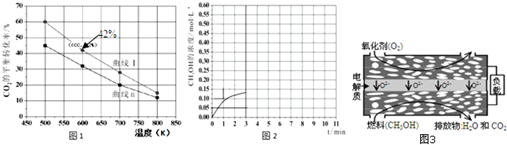
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Ba2+ | Ag+ | Na+ | Cu2+ |
| 阴离子 | NO3- | SO42- | OH- | CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、Br-、CO32- | B. | Fe2+、I-、SO32- | C. | NH4+、Br-;、SO32- | D. | Fe2+、I-、CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 充电时,Li0.85NiO2只发生氧化反应 | |
| C. | 该电池不能用水溶液作为电解质 | |
| D. | 放电过程中Li+向正极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时铅蓄电池负极电池反应 PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| B. | 充电时蓄电池阴极电极反应 PbSO4+2e-═Pb+SO42- | |
| C. | 用铅蓄电池来电解CuSO4溶液,要生成1.6g Cu,则该电池内部要消耗0.025mol H2SO4 | |
| D. | 铅蓄电池充电时,若要使3.03kg PbSO4转变为Pb和PbO2,则需要通过20mol电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
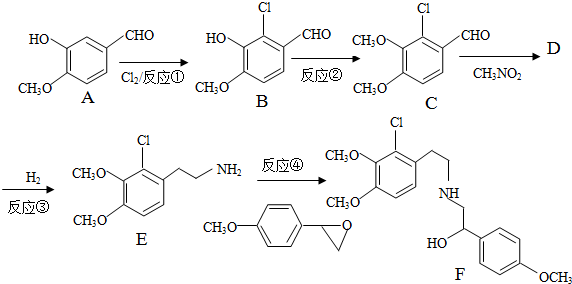
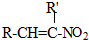 +H2O
+H2O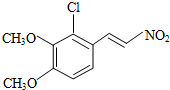 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E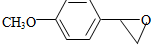 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式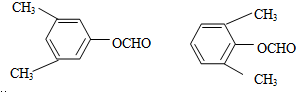 .
.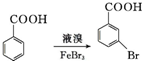 .写出以
.写出以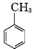 为原料制备
为原料制备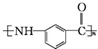 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com