
科目: 来源: 题型:选择题
| A. | CH4O+$\frac{3}{2}$O2═CO2+2H2O△H=-726.51 kJ•mol-1 | |
| B. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=+726.51 kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1453.12 kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.51 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe3+、Mg2+、ClO-、SO42- | B. | Cu2+、Fe3+、NO3-、SO42- | ||
| C. | Na+、NH4+、CO32-、NO3- | D. | K+、HCO3-、Cl-、NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5 mol/(L•min) | B. | 2mol/(L•s) | C. | 2mol/(L•min) | D. | 3mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 喷泉实验中用于收集氨气的烧瓶 | |
| B. | 中和滴定中用的滴定管 | |
| C. | 配制一定物质的量浓度溶液实验用的容量瓶 | |
| D. | 排水法收集氧气实验用的集气瓶 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单位时间内生成3n molB,同时消耗4n molC | |
| B. | 容器内压强不随时间变化 | |
| C. | 混合气体的密度不随时间变化 | |
| D. | B物质的百分含量不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
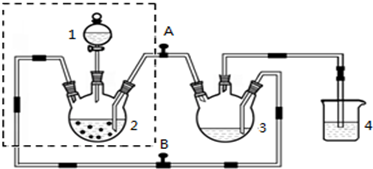
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
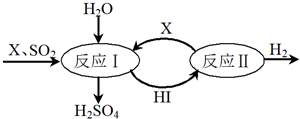
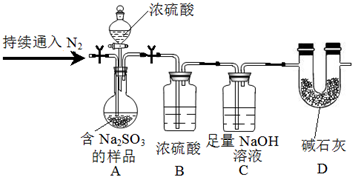
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 反应①是加成反应 | |
| B. | 反应②需要在酸性环境中进行 | |
| C. | 反应②为碱性环境时,产物结构简式是 | |
| D. | 经过上述反应,苯乙醛可以制得 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K2FeO4中铁元素的化合价是+6 | |
| B. | 制得1mol K2FeO4转移6 mol e- | |
| C. | K2FeO4做消毒剂的原因是其有强氧化性 | |
| D. | K2FeO4在消毒杀菌过程中还可以净水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com