
科目: 来源: 题型:选择题
| A. | 物质的粒子数可用摩尔这一物理量来计量 | |
| B. | 阿伏加德罗常数个粒子的质量(g)与该粒子的摩尔质量(g/mol)在数值上相等 | |
| C. | 1 L氧气与1L二氧化碳气体含有相同数目的分子 | |
| D. | 40gNaOH溶于1L水,配得1 mol/LNaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
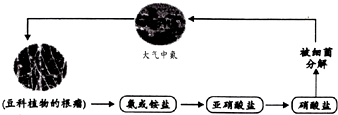
| A. | 在这一循环中氮元素既有被氧化又有被还原 | |
| B. | 其中有一种变化是氮的固定 | |
| C. | 这一循环中氮元素的化合价共有三种 | |
| D. | 由于自然界中氮的循环,使大气中氮气的含量保持稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3•H2O属于电解质 | |
| B. | Al2O3属于两性氧化物 | |
| C. | 氧化还原反应中的反应物不是氧化剂就是还原剂 | |
| D. | 燃烧反应均属于氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 滴定过程的任何时刻都存在:c(H+)+c(Na+)=c(OH-)+c(Cl-) | |
| B. | 曲线b是用氢氧化钠溶液滴定盐酸溶液的滴定曲线 | |
| C. | 氢氧化钠溶液的物质的量浓度为0.1mol?L-1 | |
| D. | P点时恰好完全中和,溶液呈中性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质的沸点:Y>Z | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠和氧气反应,条件不同,产物则不同 | |
| B. | 将钠投入氯化铵溶液中会有无色有刺激性气味的气体生成 | |
| C. | 当钠与硫酸铜溶液反应时,有大量红色固体铜生成 | |
| D. | 钠的化学性质比较活泼,少量的钠可以保存煤油中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 将一定量的Al片投入足量的NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
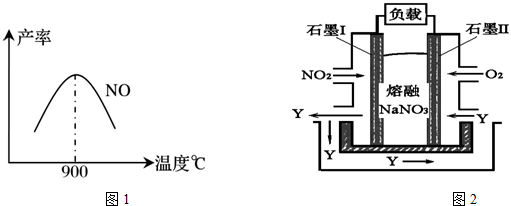
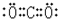 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 足量的氯气与1molFeBr2充分反应,转移的电子数为3NA | |
| B. | 1mol•L-1Al2(SO4)3溶液中,含Al3+数目为2NA | |
| C. | NA个SO3分子所占的体积约为22.4 L | |
| D. | 1mol过氧化钡(BaO2)固体中阴、阳离子总数约为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com