
科目: 来源: 题型:解答题
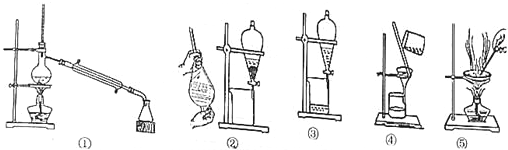
| 操作名称 | 适用对象或利用的物理性质 | 装置仪器 | 典型示例 |
| 过滤 | 除去江水中的泥沙 | ||
| 从食盐中获取NaCl晶体 | |||
| 将CCl4与水分离开 | |||
| ② | |||
| 蒸馏 | 从海水中获取淡水;工业上提纯酒精 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碘化亚铁溶液中通入少量氯气 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 少量SO2通入次氯酸钙溶液中 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 用氨水吸收过量二氧化硫 NH3•H2O+SO2═NH4++HSO3- | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠应保存在四氯化碳里以隔绝空气 | |
| B. | 高温下铁能与水蒸气反应生成氢气和三氧化二铁 | |
| C. | 漂白粉应隔绝空气密封保存,并放置在干燥避光的环境中 | |
| D. | 铝较活泼,所以铝制品在空气中不能稳定存在 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用过滤的方法除去粗盐水中悬浊的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取的方法提取碘水中的碘 | |
| D. | 用渗析的方法将制得的氢氧化铁胶体提纯 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④⑦ | B. | ①③④⑤ | C. | ②③⑥⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com