
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:填空题
 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.工业生产甲醇的常用方法是CO(g)+2H2(g)═CH3OH(g)△H<0.
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.工业生产甲醇的常用方法是CO(g)+2H2(g)═CH3OH(g)△H<0.查看答案和解析>>
科目: 来源: 题型:选择题
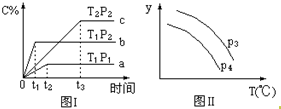 在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)?xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)?xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )| A. | P3<P4,y轴表示B的体积分数 | |
| B. | P3<P4,y轴表示混合气体的密度 | |
| C. | P3>P4,y轴表示B的百分含量 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ④⑥⑦ | B. | ⑤⑥⑧ | C. | ①③④ | D. | ①⑤⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
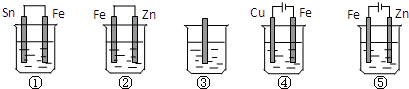
| A. | ①>②>③>④>⑤ | B. | ⑤>①>③>②>④ | C. | ⑤>①>②>③>④ | D. | ⑤>②>①>③>④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  和 和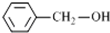 互为同系物 互为同系物 | |
| B. | 配制FeSO4溶液时,需加入少量铁粉和稀盐酸,既防止氧化又抑制水解 | |
| C. | 活化分子之间的碰撞不一定都是有效碰撞反应 | |
| D. | 对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com