
科目: 来源: 题型:选择题
| A. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| B. | 若 2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. |  如图可表示水分解过程中的能量变化 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目: 来源: 题型:解答题
 工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32ˉ+CO2+H2O═H2SiO3↓+CO32ˉ | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2ˉ+4NH4++2H2O | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32ˉ+2H+═SO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
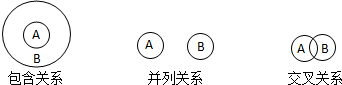
| A. | 纯净物与混合物属于包含关系 | |
| B. | 胶体与分散系属于交叉关系 | |
| C. | 置换反应与离子反应属于交叉关系 | |
| D. | 氧化还原反应与分解反应属于并列关系 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 25 | t 1 | t 2 |
| 水的离子积 KW | 1×10-14 | 1×10-13 | 1×10-12 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在常温下,向 0.01mol?L-1 的 NH4HSO4 溶液中滴加 NaOH 溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH- )=c(H+) | |
| B. | 25℃时,在 0.1mol?L-1 的 NaHSO4 溶液中,c(H+)=c(OH- )+c(SO42-) | |
| C. | 浓度均为 0.1mol?L-1 的 HF 溶液和 KF 溶液等体积混合:c(F-)+c(HF)=0.2mol/L | |
| D. | 均为 0.1mol?L-1 的 Na2S 溶液和 NaHS 溶液等体积混合:2c(Na+)=3c(HS-)+3c(H2S)+3c(S2-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 | |
| B. | 施肥时,草木灰(有效成分为 K2CO3)不能与碳酸氢铵混合使用 | |
| C. | Al2S不能用复分解反应的方法在溶液中制取,而只能用干法制备 | |
| D. | 配制 FeCl2溶液时常常要在溶液中加入少量铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com