
科目: 来源: 题型:选择题
| A. | NaHCO3俗名纯碱,Na2CO3俗名苏打 | |
| B. | 受热时,NaHCO3比Na2CO3容易分解 | |
| C. | NaHCO3溶液显酸性,Na2CO3溶液显碱性 | |
| D. | NaHCO3和Na2CO3各1mol分别与过量盐酸充分反应,产生CO2的质量不同 |
查看答案和解析>>
科目: 来源: 题型:解答题
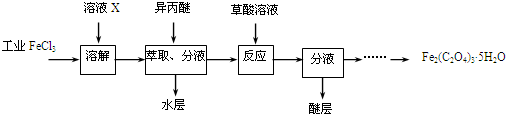
查看答案和解析>>
科目: 来源: 题型:解答题
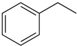 (g)→
(g)→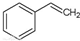 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; +CO(g)+H2O(g) △H=+158.8 kJ/mol
+CO(g)+H2O(g) △H=+158.8 kJ/mol
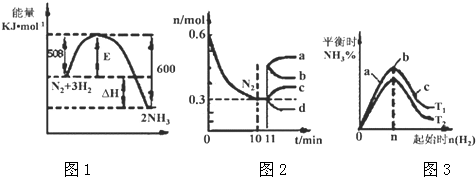
查看答案和解析>>
科目: 来源: 题型:解答题
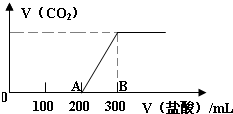 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X:氯化铝溶液 Y:氨气 | |
| B. | X:氢氧化铁胶体 Y:氯化氢 | |
| C. | X:澄清石灰水 Y:二氧化碳 | |
| D. | X:四羟基合铝酸钠溶液 Y:氯化氢 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 11.7g | B. | 23.4 g | C. | 26.5g | D. | 58.5g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 32g氧气和臭氧的混合气体中所含的原子数为2NA | |
| B. | 常温常压下,22.4LCO2含有的分子数目为NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移的电子数为0.2NA | |
| D. | 0.1mol OH-含有NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com