
科目: 来源: 题型:多选题
| A. | 标准状况下,22.4 L的H2O中含有的分子数为NA | |
| B. | 7.8g Na2S固体和7.8 g Na2O2固体中含有的阴离子数目均为0.1NA | |
| C. | 46克 Na与足量氧气反应转移的电子数为2NA | |
| D. | 1 L 1mol•L-1 Na2CO3溶液中含有的钠离子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 醋酸的电离 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同位素:14C与14N | |
| B. | 同系物:丙烷、异丁烷、新戊烷 | |
| C. | 电解质:冰醋酸、水银、烧碱 | |
| D. | 酸性氧化物:一氧化氮﹑二氧化碳、三氧化硫 |
查看答案和解析>>
科目: 来源: 题型:解答题
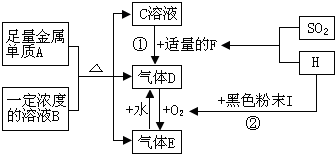
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 24g | B. | 18g | C. | 21.6g | D. | 25.2g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 开始时,产生氢气的速率相同 | |
| B. | 参加反应的金属的物质的量比为1:1:1 | |
| C. | 所得溶液的质量相等 | |
| D. | 参加反应的金属的质量比为12:9:28 |
查看答案和解析>>
科目: 来源: 题型:解答题
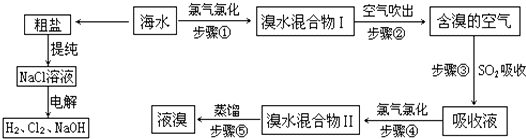
查看答案和解析>>
科目: 来源: 题型:解答题
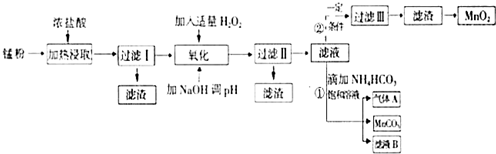 面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时PH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时PH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体需要进行尾气处理 | |
| D. | 实验②证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com