
科目: 来源: 题型:选择题
| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | 无色透明的酸性溶液中:Al3+、NH4+、Cl?、HCO3? | |
| C. | pH=1的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3 COO-、SO42-、Na+、NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯碱溶液可去除油污 | |
| B. | 用NaHCO3溶液和Al2(SO4)3溶液可以制作泡沫灭火剂 | |
| C. | TiCl4溶于大量水加热制备TiO2 | |
| D. | 用锌粒与稀硫酸反应制取氢气时滴加少量CuSO4溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
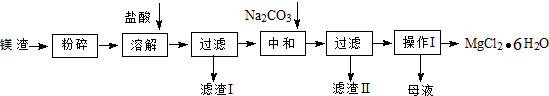
查看答案和解析>>
科目: 来源: 题型:解答题
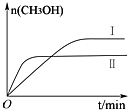 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.
查看答案和解析>>
科目: 来源: 题型:解答题
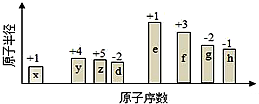 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题: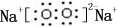 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)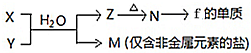
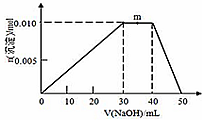
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5ν(NH3)=4ν(O2) | B. | 5ν(O2)=6ν(H2O) | C. | 2ν(NH3)=3ν(H2O) | D. | 5ν(O2)=4ν(NO) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 均存在电离平衡 | B. | 阴离子数目前者大于后者 | ||
| C. | c(OH-)前者小于后者 | D. | 存在的粒子种类相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| B. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
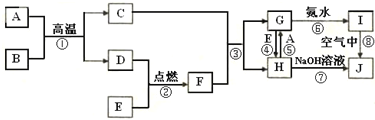
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,1.56g Na2O2含有的阴离子数为0.02NA | |
| B. | 标准状况下,22.4L SO3含有的分子数为NA | |
| C. | 0.1mol氯气参与反应,转移的电子数一定为0.2NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Clˉ个数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com