
科目: 来源: 题型:解答题
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (Ⅰ)取氯化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (Ⅱ)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O |
| 实验二 | (Ⅰ)取实验一得到的溶液,加入KSCN溶液. (Ⅱ)再加入少量H2O2溶液. | 颜色无明显变化 溶液变红,有少量气泡 |
| 实验三 | (Ⅰ)取10mL 0.1mol/L KI溶液,滴加6滴0.1mol/L FeCl3溶液. (Ⅱ)取少量上述黄色溶液,滴加KSCN溶液. (Ⅲ)另取上述的黄色溶液,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (Ⅰ)向实验三步骤I中所得的黄色溶液中加入2mL CCl4,充分振荡后,分离得到水层;重复操作三次. (Ⅱ)向步骤I中所得水层中加入KSCN溶液. | 颜色无明显变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=1.6 mol•L-1•s-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 焦糖烯能使溴水褪色 | |
| B. | “半成品碳”是碳元素的一种新单质 | |
| C. | 蔗糖溶液与新制的氢氧化铜悬浊液混合加热有砖红色沉淀生成 | |
| D. | 焦糖烯是一种新型的烯经 |
查看答案和解析>>
科目: 来源: 题型:解答题
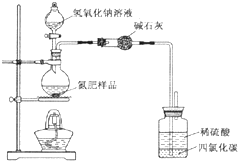 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
样品质量/g | 7.750 | 15.50 | 23.25 |
氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 步骤I: ① . 步骤II:配制与0.1 mol/L Fe(NO3)3 溶液所含c (H+)、 c (NO3-) 相同的溶液,取适量此溶液放入到新制备的银镜中. | ② ,乙同学的推测 成立;反之,则不成立. |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuSO4 | B. | CuO | C. | CuSO4•5H2O | D. | Cu(OH)2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

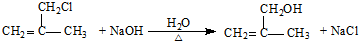 ;⑨的化学方程式是
;⑨的化学方程式是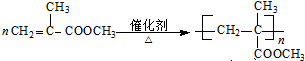 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com