
科目: 来源: 题型:选择题
| A. | 我国规定商家不得无偿提供塑料袋,目的是减少“白色污染” | |
| B. | 乙醇是一种易燃烧污染小的可再生能源,但只能在实验室内作燃料 | |
| C. | 化石燃料不可再生,使用太阳能代替化石燃料,有利于节约资源、保护环境 | |
| D. | 积极开发废电池的综合利用技术,防止其中的重金属盐对土壤和水源造成污染 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可以用米汤检验加碘食盐中的碘酸钾(KIO3) | |
| B. | 鱼、肉、虾等食品用福尔马林防腐保鲜 | |
| C. | 利用葡萄糖和银氨溶液,可在玻璃上镀银 | |
| D. | 缺钠会产生贫血,常在酱油中补钠 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ② | B. | ②④ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蛋白质遇浓硝酸变黄 | |
| B. | 含钠元素的物质在火焰上灼烧产生黄色火焰 | |
| C. | pH试纸与某溶液接触变为红色 | |
| D. | 无色浓硝酸久置后变黄 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汽油失火时,立即用水灭火 | |
| B. | 加热液体的试管口不能正对着自己或别人 | |
| C. | 浓NaOH溶液洒到皮肤上,用大量水冲洗后,再涂上5%的硼酸溶液 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
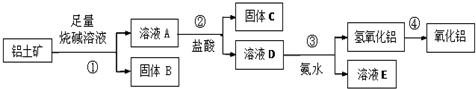
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com