
科目: 来源: 题型:解答题
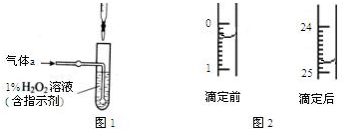
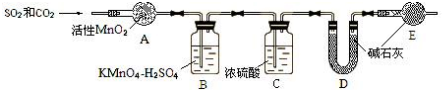
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温下的某 NaF 溶液中,c(H+)=1×10-10 mol?L-1,说明 NaF 使水的电离减弱 | |
| B. | Mg 在空气中燃烧时发出耀眼的白光,一部分化学能转化为光能 | |
| C. | 纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 | |
| D. | 反应 N2(g)+3H2(g)═2NH3(g)(△H<0)达平衡后,降低温度,正、逆反应速率都减小,平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
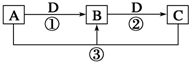 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2O | B. | NO | C. | NO2 | D. | N2O4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H2CO3 | Fe(OH)3 |
| 非电解质 | 蔗糖 | BaSO4 | C2H5OH | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2mLNO | B. | 8mLNO2和4mLO2 | C. | 2mLO2 | D. | 0.25mLO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4含有4nA个Cl原子 | |
| B. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 | |
| C. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| D. | 常温常压下,23 gNO2、N2O4混合气体中含有nA个氧原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO3-、SO42-、NH4+、Mg2+ | B. | Cu2+、Mg2+、Cl-、SO42- | ||
| C. | H+、K+、OH-、NO3- | D. | Ag+、Na+、NO3-、CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中毒过程中NO2-表现还原性 | |
| B. | 中毒过程中Fe2+表现氧化性 | |
| C. | 解毒过程中维生素C具有还原性 | |
| D. | 解毒过程中维生素C把Fe2+氧化为Fe3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023 | |
| B. | 反应MgCl2(l)=Mg(l)+Cl2(g)的△H<0、△S>0,故任何温度下都能自发进行 | |
| C. | 电解精炼铜过程中,电路中每通过1mol电子,阳极溶解铜32g | |
| D. | 0.1mol/LNa2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HSO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com