
科目: 来源: 题型:选择题
| A. | 反应(1)和(2)均为氧化还原反应 | |
| B. | 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3 | |
| C. | 高温下,O2的氧化性大于Fe2O3小于Na2CrO4 | |
| D. | 生成1mol的Na2Cr2O7时共转移8mol电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
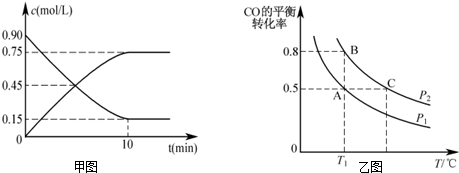
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在密闭容器中加入1molN2和3molH2充分反应可得到NH3分子数为2NA | |
| B. | 20 g重水(D2O)中含有的电子数为10NA | |
| C. | 粗铜电解精炼时,阳极质量减少6.4 g,则转移电子数一定是0.2NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钢铁发生析氢腐蚀时,负极电极反应是Fe-2e-=Fe2+ | |
| B. | 根据盖斯定律,可计算某些难以直接测定的反应焓变 | |
| C. | 增大压强不能降低活化能,但能增加活化分子百分数 | |
| D. | 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0△S>0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸碱中和反应 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.1 mol•L-1的NH4Cl和0.1 mol•L-1的NH3•H2O等体积混合后溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量盐酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)=c (CH3COO-) | |
| D. | 0.1 mol•L-1的NaHS溶液中离子浓度关系:c (OH-)=c (H+)-c (S2-)+c (H2S) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀氨水 | B. | NaOH溶液 | C. | 硫氰化钾溶液 | D. | Cu2(OH)2CO3固体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.25mol•L-1 | B. | 2mol•L-1 | C. | 0.6mol•L-1 | D. | 0.3mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 16.51 g | B. | 23.82 g | C. | 24.84 g | D. | 17.02 g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 碳酸钠溶液与硫酸氢钠溶液反应:CO32-+H+═CO2↑+H2O | |
| C. | Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com