
科目: 来源: 题型:解答题
 如图是中学化学实验中出现频率较高的装置,它是由物质制备、生成物性质检验和尾气处理三部分组成.请你用中学化学常见试剂设计一个实验.通过乙中的反应和丙中的实验现象,得出三种物质性质递变的结论.试将试剂名称、丙中的实验现象及由此得出的实验结论填入下列空白处.
如图是中学化学实验中出现频率较高的装置,它是由物质制备、生成物性质检验和尾气处理三部分组成.请你用中学化学常见试剂设计一个实验.通过乙中的反应和丙中的实验现象,得出三种物质性质递变的结论.试将试剂名称、丙中的实验现象及由此得出的实验结论填入下列空白处.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 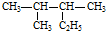 按系统命名法的名称为:2-甲基-3-乙基丁烷 按系统命名法的名称为:2-甲基-3-乙基丁烷 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 根据纤维在火焰上燃烧产生的气味,可确定该纤维是否为蛋白纤维 | |
| D. | 等质量的甲醛、葡萄糖、纤维素完全燃烧时的耗氧量相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用量筒量取10.00 mL 1.0mol•L-1的盐酸于100mL容量瓶中,加水定容至刻度,可配得0.1mol•L-1的盐酸 | |
| B. | 做焰色反应时,若连续做两个样品,应将铂丝用硫酸洗净并灼烧到无色 | |
| C. | 取试样与氢氧化钠浓溶液共热,产生能使湿润红色石蕊试纸变蓝色的气体,则说明试样中有NH4+ | |
| D. | 直接用分液的方法分离乙酸和乙酸乙酯 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目: 来源: 题型:解答题
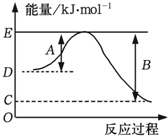 火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.| 化学键 | H-H | O=O | O-H |
| 键能 (kJ•mol-1) | 436 | x | 463 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴有碘水的淀粉溶液10ml分成两等份于两支试管,分别加入稀硫酸和唾液1ml,振荡,前者褪色快 | |
| B. | 恒温下,将盛有NO2和N2O4的平衡体系加压,体系颜色最终变浅 | |
| C. | 草酸溶液与酸性KMnO4溶液混合后,由于生成物对反应有催化作用,会使反应速率加快 | |
| D. | 在K2Cr2O7溶液中滴加浓硫酸,溶液颜色由橙色变黄色 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
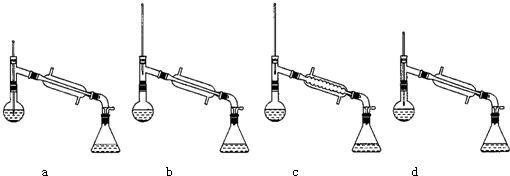
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| B. | 浓硫酸溶于水会放出大量热,这属于放热反应 | |
| C. | 用氢氧焰可以加热软化玻璃制玻璃器皿,这利用了氢气和氧气化合时放出的热量 | |
| D. | 木炭需加热到一定温度时才燃烧,所以木炭燃烧是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com