
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
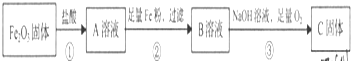
查看答案和解析>>
科目: 来源: 题型:解答题
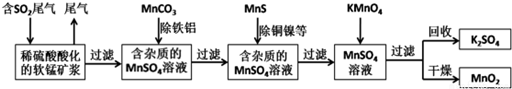
查看答案和解析>>
科目: 来源: 题型:解答题
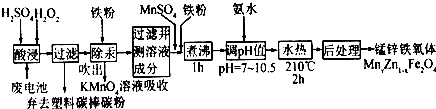
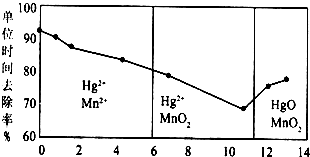
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
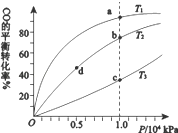
| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(b)>υ(d)v(a)>υ(c) | ||
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) | D. | 平均摩尔质量:M(b)>M(d)M(a)<M(c) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol | B. | 0.15 mol | C. | 0.22 mol | D. | 0.05 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硝酸银溶液中加入氯化钠:Ag++Cl-═AgCl↓ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol Na2O2中含有的阴离子数为2NA | |
| B. | 标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NA | |
| C. | 常温常压下,8g O3含有4 NA个电子 | |
| D. | 常温下,1L pH=2的H2SO4溶液中含有的H+数目为0.02NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化合物:干冰,冰水混合物,烧碱 | B. | 同素异形体:活性炭,C60,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:漂白粉,纯净矿泉水,盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com