
科目: 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | agC2H4和C3H6的混合物所含原子总数为$\frac{3a{N}_{A}}{14}$ | |
| B. | 1.00mol/LNaCl溶液100mL,含有6.02×1022个NaCl分子 | |
| C. | 300mL2mol/L蔗糖溶液中所含分子数大于0.6NA | |
| D. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 煤的气化和液化都是物理变化,向煤中加入适量CaSO4,可大大减少产物中SO2的量 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | PM 2.5、二氧化碳都属于空气质量日报的内容 | |
| D. | Na、K合金熔点低,可用作原子反应堆的导热剂 |
查看答案和解析>>
科目: 来源: 题型:填空题
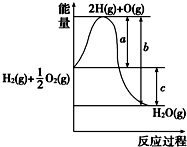
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
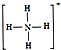 ,白磷(P4)的结构式为
,白磷(P4)的结构式为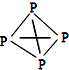 ,请画出N4H44+的结构式
,请画出N4H44+的结构式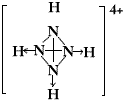 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com