
科目: 来源: 题型:选择题
| A. | 2.0gH218O与D20的混合物中所含中子数为NA | |
| B. | 等物质的量的水与重水含有的中子数相等 | |
| C. | 18gD20和18gH20中含有的质子数均为10NA | |
| D. | 235g核素$\left.\begin{array}{l}{235}\\{92}\end{array}\right.$U发生裂变反应:$\left.\begin{array}{l}{235}\\{92}\end{array}\right.$U+$\left.\begin{array}{l}{1}\\{0}\end{array}\right.$n$\frac{\underline{\;裂变\;}}{\;}$$\left.\begin{array}{l}{90}\\{38}\end{array}\right.$Sr+$\left.\begin{array}{l}{136}\\{54}\end{array}\right.$U+10$\left.\begin{array}{l}{1}\\{0}\end{array}\right.$n净产生的中子($\left.\begin{array}{l}{1}\\{0}\end{array}\right.$n)数为10NA |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
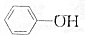 ,③
,③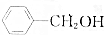 ,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )
,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )| A. | 3类 | B. | 4类 | C. | 5类 | D. | 6类 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题
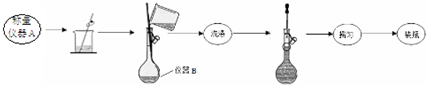
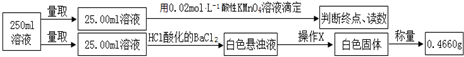
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•Lˉ1BaCl2溶液 | B. | 澄清石灰水 | ||
| C. | 稀盐酸 | D. | pH试纸 |
查看答案和解析>>
科目: 来源: 题型:解答题
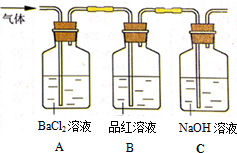 工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑
工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com