
科目: 来源: 题型:选择题
| A. | 金属氧化物 氧化铁 FeO | |
| B. | 非金属氧化物 二氧化硫 SO2 | |
| C. | 碱性氧化物 过氧化钠 Na2O2 | |
| D. | 碱 纯碱 Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 第②步反应的化学方程式为: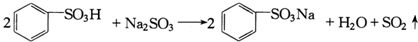 | |
| B. | 第③步反应中除了苯酚钠还会生成Na2SO4 | |
| C. | 第④步反应可表示为: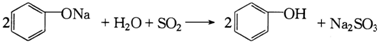 | |
| D. | 根据上述反应判断酸性强弱为: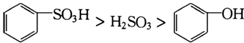 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 | |
| C. | 工业上常用电解C、D的盐溶液来制备C、D元素的单质 | |
| D. | 化合物AE与CE有相同类型的化学键 |
查看答案和解析>>
科目: 来源: 题型:选择题
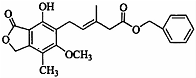
| A. | 分子中所有的原子共平面 | |
| B. | 既可以与FeCl3溶液发生显色反应.又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 1 mol该化合物最多可以与9mol H2发生加成反应 | |
| D. | 该物质能发生取代反应、氧化反应、加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
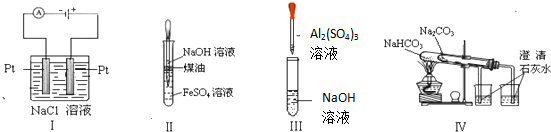
| A. | 实验Ⅰ:制取金属钠 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:制取少量的氢氧化铝 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42- | |
| B. | c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO- | |
| C. | 能使pH试纸变红的溶液中:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=0的溶液中:Mg2+、Na+、F-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.012 kg 12C中含有约6.02×1023个碳原子 | |
| B. | 1 mol H2O中含有2 mol氢和1 mol氧 | |
| C. | 物质的量就是1 mol物质的质量 | |
| D. | 2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
查看答案和解析>>
科目: 来源: 题型:选择题
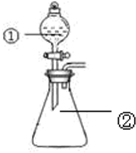 用如图所示装置进行下列实验:将①中溶液滴入②锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②锥形瓶中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | SO2饱和溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用干燥的pH试纸测定NaClO溶液的pH | |
| B. | 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验 | |
| C. | 用分液漏斗分离溴苯和水的混合物时,溴苯从下口放出,水从上口倒出 | |
| D. | 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 | |
| D. | 2V正(CrO42-)=V逆(Cr2O72-)时,反应处于平衡态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com