
科目: 来源: 题型:解答题

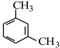 ;
;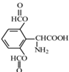 、
、 ;
; +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$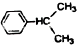 结合相关信息,请写出以
结合相关信息,请写出以 、CH2=CH2和
、CH2=CH2和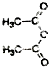 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目: 来源: 题型:解答题
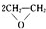
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目: 来源: 题型:解答题
 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 干法中生成的高铁酸钠既是氧化产物又是还原产物 | |
| B. | 湿法中每生成1mol Na2FeO4 转移3mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4 转移4mol电子 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质 |
查看答案和解析>>
科目: 来源: 题型:选择题
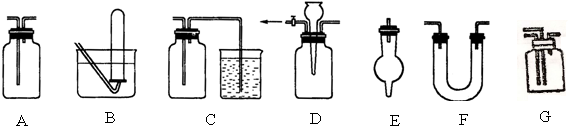
| A. | A、B装置既能用于收集Cl2,又能用于收集NO | |
| B. | 装有浓硫酸的F装置可用于干燥CO2气体 | |
| C. | C、E用于尾气吸收能防止液体倒吸到气体发生装置中 | |
| D. | G装置可用于合成氨实验中,可干燥、混合并能大致观察H2和N2的体积比 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
查看答案和解析>>
科目: 来源: 题型:选择题
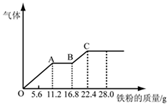 向稀硫酸和稀硝酸的混合溶液200mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体).下列分析错误的是( )
向稀硫酸和稀硝酸的混合溶液200mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体).下列分析错误的是( )| A. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2 | |
| B. | A点溶液中的溶质为Fe(NO3)3和H2SO4 | |
| C. | 原混合酸中NO3-物质的量为0.2mol | |
| D. | 原混合酸中H2SO4的物质的量浓度为2mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第三周期非金属元素氧化物水化物的酸性从左到右依次增强 | |
| B. | 水加热到很高的温度都难以分解是因为水分子间存在氢键 | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素的种类由核内质子数决定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在25℃101KPa下,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 | |
| B. | 表示中和热的化学方程式:H++OH-=H2O△H=-57.3kJ•mol-1 | |
| C. | 将水库中的水闸(钢板)与外加直流电源的正极相连,负极连接到一块废铁上可防止闸被腐蚀 | |
| D. | 已知热化学方程式:S(s)+O2(g)=SO2(g)△H=a kJ•mol-1 S(g)+O2(g)=SO2(g)△H=ba kJ•mol-1 则b>a |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4LCHCl3中含有的氯原子数目为3NA | |
| B. | 46g二氧化氮含有的原子总数一定为3NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2NHO3+4N2↑+9H2O该反应生成28gN2时,转移的电子数目为4NA | |
| D. | 在密闭容器中加入1,5molH2和0.5molN2,充分反应后可得到NH3分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com