
科目: 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②④⑤⑥ | C. | ②③④⑤ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 反应阶段 | I | II | III |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
| 解释 | CO32-+H+=HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、Na+、Cl-、OH- | B. | Fe3+、H+、Cl-、CH3COO- | ||
| C. | Fe3+、SCN-、K+、Cl- | D. | H+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题
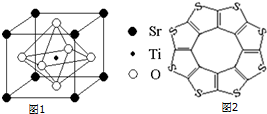
| C-S | C═S | C16S8中碳硫键 | |
| 键长/pm | 181 | 155 | 176 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
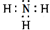 ,含有的化学键类型是极性共价键
,含有的化学键类型是极性共价键查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 镁铝合金的抗腐蚀能力强,不与稀硫酸反应 | |
| B. | Na的金属活动性比Mg的强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 钠可与冷水剧烈反应,而镁与热水才能反应,说明钠比镁活泼 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中,Fe也显+3价 |
查看答案和解析>>
科目: 来源: 题型:选择题
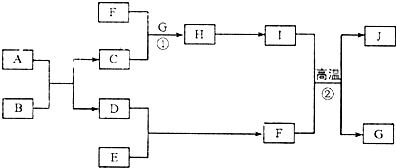
 下列各组物质中,能一步实现如图所示①~⑤转化关系的是( )
下列各组物质中,能一步实现如图所示①~⑤转化关系的是( )| X | Y | Z | W | |
| A | C | CO | CO2 | Na2CO3 |
| B | Fe3O4 | Fe | FeCl2 | FeCl3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,原因是二者可以发生双水解反应 | |
| B. | 电解精炼铜时,若阴极得到1.204×1024个电子,则阳极质量减少6.4g | |
| C. | 使甲基橙变红色溶液:Mg2+、K+、SO42-、NO3-能大量共存 | |
| D. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+O2+4H+=2S+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com