
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ•mol1) | 414.4 | 615.3 | 347.4 | 435.3 |
| A. | +125.6 kJ•molˉ1 | B. | -125.6 kJ•molˉ1 | C. | +46.1 kJ•molˉ1 | D. | -46.1 kJ•molˉ1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用托盘天平称量时,将NaOH固体放在左盘内的纸上,称得质量为10.2 g | |
| B. | 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL | |
| C. | 用广泛pH试纸测稀盐酸的pH=3.2 | |
| D. | 用10 mL量筒量取NaCl溶液,体积为9.2 mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | HCl | D. | NaOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数为NA | |
| B. | 常温常压下,1.06克Na2CO3含有的Na离子数为0.02NA | |
| C. | 通常状况下,1NA个H2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl离子个数为NA |
查看答案和解析>>
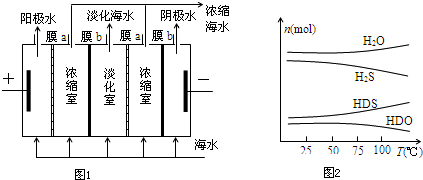
科目: 来源: 题型:解答题
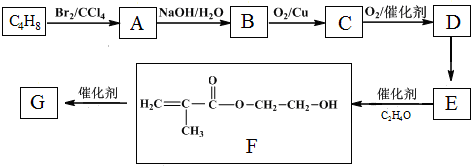
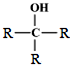 $\stackrel{O_{2}/Cu}{→}$不能被氧化
$\stackrel{O_{2}/Cu}{→}$不能被氧化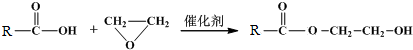
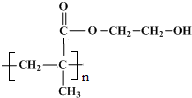 .
.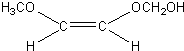 、
、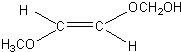 、
、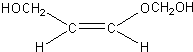 、
、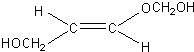 .
.查看答案和解析>>
科目: 来源: 题型:解答题
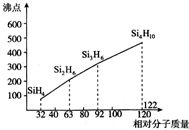 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目: 来源: 题型:解答题
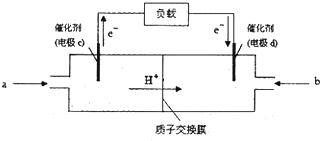
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氟酸、食盐水 | B. | 氨水、碘酒 | C. | 石灰水、硝酸 | D. | 稀硫酸、食醋 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com