
科目: 来源: 题型:选择题
| A. | NaHCO3溶液中存在:c(OH-)=c(H+)+c(H2CO3) | |
| B. | 某二元弱酸强碱盐NaHA溶液中存在:c(Na+)+c(H+)=c(A2-)+c(HA-)+c(OH-) | |
| C. | CH3COONa和NaCl混合溶液中存在:c(Na+)=c(CH3COO-)+c(Cl-) | |
| D. | 常温下,10mL 0.02mol•L-1 HCl溶液与10mL 0.01mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
科目: 来源: 题型:解答题
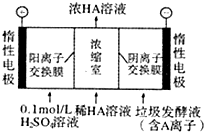 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| B. | NH4Cl和NH3•H2O混合液中,二者对对方的平衡都起了抑制作用 | |
| C. | 有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) | |
| D. | 常温下0.1mol•L-1的HA溶液中c(OH-)/c(H+)=10-8,则0.01 mol•L-1HA溶液中c(H+)=1×10-4mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、H+、SO32-、H2O2 | B. | Al3+、Mg2+、OH-、CO32- | ||
| C. | K+、OH-、Cl-、NH3•H2O | D. | Ba2+、Fe3+、NO3-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、NH4+、OH-、NO3- | B. | Mg2+、Na+、AlO2-、OH- | ||
| C. | Na+、Ba2+、OH-、SO42- | D. | Cu2+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制蒸馏水 | |
| B. | 粗盐提纯 | |
| C. | 用氢气还原氧化铜 | |
| D. | 用氯化钠晶体配制100mL0.1mol•L-1的氯化钠溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
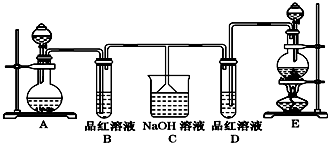
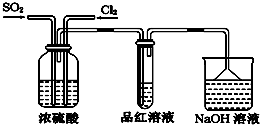
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl-、Na+、SO42-、Al3+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Ba2+、Cl-、SO42- | D. | Fe2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com