
科目: 来源: 题型:解答题
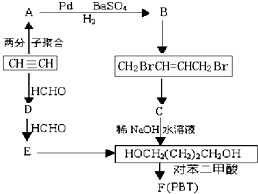 请根据以下知识解答
请根据以下知识解答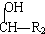 (R代表烃基,下同.)
(R代表烃基,下同.)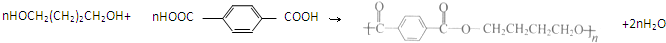 .
.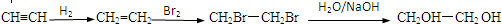 .
.查看答案和解析>>
科目: 来源: 题型:解答题
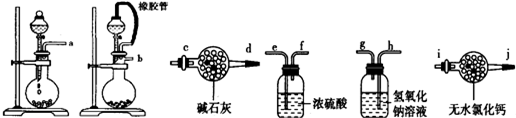
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
查看答案和解析>>
科目: 来源: 题型:解答题
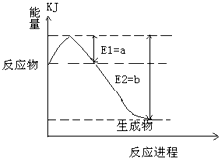 合成氨工业对国民经济和社会发展具有重要意义
合成氨工业对国民经济和社会发展具有重要意义
查看答案和解析>>
科目: 来源: 题型:解答题
 .K在周期表的位置是第四周期ⅠA;25Mn属于ⅦB或副族族元素.
.K在周期表的位置是第四周期ⅠA;25Mn属于ⅦB或副族族元素.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 将少量SO2气体通入NaClO溶液中:2ClO-+SO2+H2O→SO32-+2HClO | |
| B. | 硫化氢气体通入硫酸亚铁溶液产生黑色硫化亚铁沉淀:H2S+Fe2+→FeS↓+2H+ | |
| C. | 向偏铝酸钠溶液中通入过量CO2:AlO2-+CO2+2H2O→Al(OH)3↓+HCO3- | |
| D. | 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Na2O2+2Mn2O7→4NaMnO4+O2↑ | B. | 2Na2O2+P2O3→Na4P2O7 | ||
| C. | 2Na2O2+2 N2O3→NaNO2+O2↑ | D. | 2 Na2O2+2 N2O5→4NaNO3+O2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
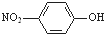

| A. | ①④⑤ | B. | ①②③④⑤ | C. | ③⑤⑥⑦ | D. | 全部正确 |
查看答案和解析>>
科目: 来源: 题型:选择题
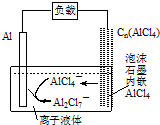 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl7-+Cl- | |
| B. | 放电时,电路中每流过3mol电子,正极减少27g | |
| C. | 充电时,泡沫石墨极与外电源的负极相连 | |
| D. | 充电时,阴极发生:4Al2Cl7-+3e-=Al+7AlCl4- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com