
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 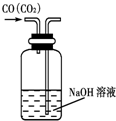 除去CO气体中的CO2气体 | B. | 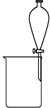 分 分离碘酒中的碘和酒精 | ||
| C. | 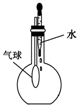 验证NH3的溶解性 | D. | 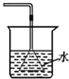 吸收HCl防倒吸 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯元素在自然界中只以化合态形式存在 | |
| B. | H2在Cl2中燃烧会产生苍白色火焰 | |
| C. | 漂粉精是混合物,其有效成分是次氯酸钠 | |
| D. | 久置氯水最终变为稀盐酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
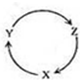 下表各组物质中,满足下右图物质一步转化关系的选项是( )
下表各组物质中,满足下右图物质一步转化关系的选项是( ) | X | Y | Z | |
| A | N2 | NO2 | NH4NO3 |
| B | Al | Al2O3 | NaAlO2 |
| C | Cu | CuO | CuCl2 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 氨在国民经济中占有重要地位,具有广泛的用途.
氨在国民经济中占有重要地位,具有广泛的用途. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO2和N2O4组成的46g混合气体中氮原子的数目为NA | |
| B. | 1molC2H2分子中含有σ键的数目为2NA | |
| C. | HClO光照分解产生22.4LO2,转移的电子数为4NA | |
| D. | 常温下,1L0.1mol/LFe2(SO4)3溶液中阳离子数小于0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
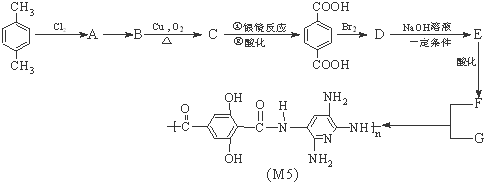
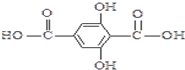 .
.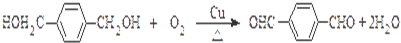 ,
,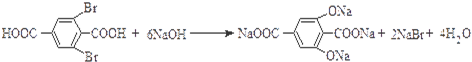 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com