
科目: 来源: 题型:解答题
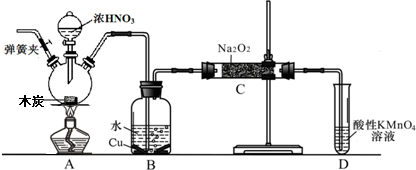
查看答案和解析>>
科目: 来源: 题型:解答题
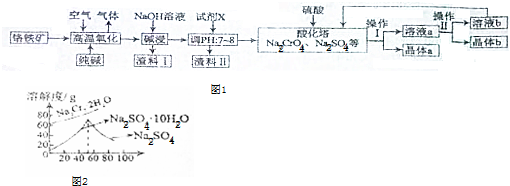
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)?2SO3(g)△H<0的影响如图所示,下列说法正确的是( )
在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)?2SO3(g)△H<0的影响如图所示,下列说法正确的是( )| A. | 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行 | |
| B. | a、b、c三点的平衡常数Kb>Kc>Ka | |
| C. | 上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高 | |
| D. | a、b、c三点中,a点时SO2的转化率最高 |
查看答案和解析>>
科目: 来源: 题型:选择题
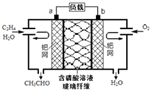 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | a电极发生还原反应 | |
| B. | 放电时,每转移2mol电子,理论上需要消耗28g乙烯 | |
| C. | b极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 前三种均有可能 |
查看答案和解析>>
科目: 来源: 题型:选择题
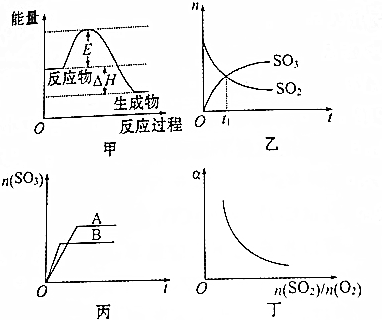
| A. | 加入适当的催化剂后,甲图中的E和△H都减小 | |
| B. | 乙图中t1时刻反应达到化学平衡状态 | |
| C. | 丙图可以表示其他条件不变时,压强对反应的影响 | |
| D. | 丁图中a可以表示SO2的转化率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2mol SO2和足量的O2反应,必定生成2mol SO3 | |
| B. | 当v(正)>V(逆)时,随着反应的进行,反应物的物质的量逐渐减小 | |
| C. | 正反应速率之比为v(SO2):v(O2):v(SO3)=2:1:2时,反应达到平衡 | |
| D. | 反应达到平衡后,升高温度,平衡不一定发生移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
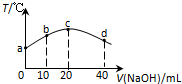 常温下,若往20mL 0.01mol•L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
常温下,若往20mL 0.01mol•L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 所加烧碱溶液PH=12,c点水的离子积常数KW=10-14 | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com