
科目: 来源: 题型:选择题
| A. | SO2具有漂白性 | B. | SO2为酸性氧化物 | C. | SO2具有还原性 | D. | SO2具有氧化性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl2既是氧化剂也是还原剂 | |
| B. | 被氧化的氯原子数是被还原的氯原子数的5倍 | |
| C. | 当有11.7 g的NaCl生成时,电子转移数为0.2NA | |
| D. | NaCl是还原产物,NaClO3是氧化产物 |
查看答案和解析>>
科目: 来源: 题型:解答题
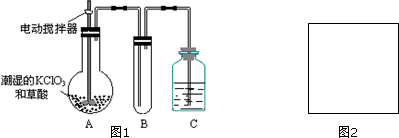 X+5H2O,则X的化学式NaCl.
X+5H2O,则X的化学式NaCl.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3固体 | B. | 3 mol•L-1的H2SO4溶液 | ||
| C. | CH3COOK溶液 | D. | KNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | B. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3 | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com