
科目: 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 铜片与浓HNO3:Cu+2NO3-+4H+═Cu2++NO2↑+2H2O | |
| C. | 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
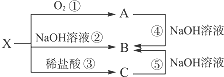 已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
查看答案和解析>>
科目: 来源: 题型:解答题
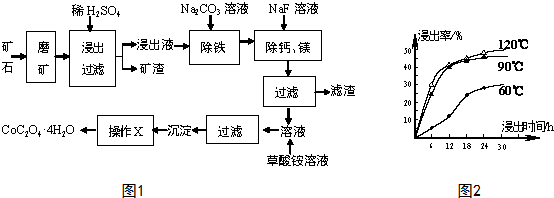
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用氨水吸收足量的SO2气体:2OH-+SO2═SO32-+H2O | |
| B. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S$→_{燃烧}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | CuSO4(aq)$\stackrel{过量NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 彩色密封塑胶袋能造成白色污染 | |
| B. | 钠、氧化钠、氢氧化钠都能与醋酸反应得到醋酸钠 | |
| C. | 化学变化都伴随着能量的变化 | |
| D. | 大多数合金比各成分金属硬度小,熔点低 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 氢氧化钠溶液、碳酸钠溶液、氯化钡溶液 | |
| B. | 氢氧化钠溶液、氯化钡溶液、碳酸钠溶液 | |
| C. | 氯化钡溶液、碳酸钠溶液、氢氧化钠溶液 | |
| D. | 碳酸钠溶液、氯化钡溶液、氢氧化钠溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
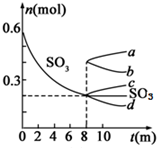 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com