
科目: 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目: 来源: 题型:解答题
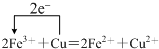 .
.查看答案和解析>>
科目: 来源: 题型:解答题
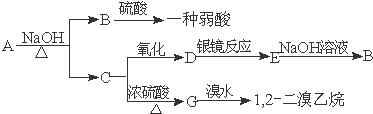
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 表面附着氨水的碳素钢在空气中主要发生析氢腐蚀 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl (s)的△H<0,△S<0 | |
| C. | 25℃时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液的pH>7 | |
| D. | 向2NH3(g)?N2(g)+3H2(g)的平衡体系中加入催化剂,NH3的平衡转化率增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
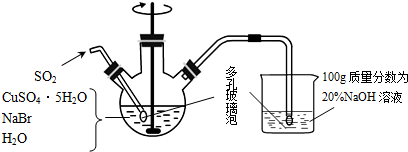
 某学生在如图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题:
某学生在如图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题: .
.查看答案和解析>>
科目: 来源: 题型:选择题
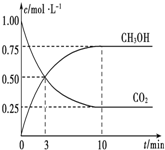 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A. | 欲增大平衡状态时$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$的比值,可采用升高温度的方法 | |
| B. | 达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 欲提高H2的平衡转化率只能加压减小反应容器的体积 | |
| D. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
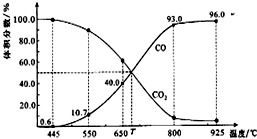 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )| A. | 550℃时,若充入惰性气体,v正,?逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com