
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
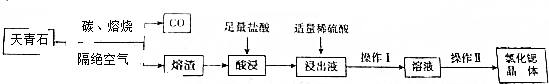
查看答案和解析>>
科目: 来源: 题型:解答题
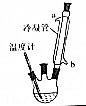 肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下:
肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下: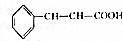 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$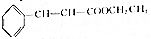 +H2O
+H2O | 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | 78.3 | 与水互溶 |
| 肉桂酸 | 148 | 1.245 | 300 | 微溶于水 |
| 肉桂酸乙酯 | 176 | 1.049 | 270 | 不溶于水 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
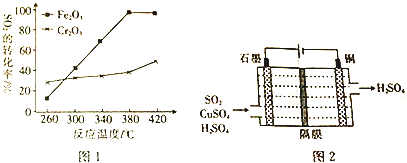
查看答案和解析>>
科目: 来源: 题型:填空题
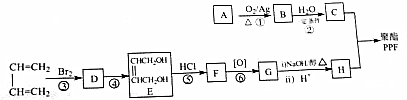

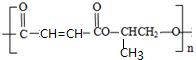 .
.查看答案和解析>>
科目: 来源: 题型:填空题
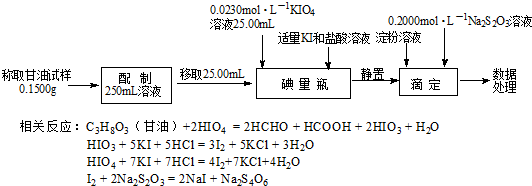
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入醋酸钠固体,可抑制醋酸的电离 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1盐酸,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com