
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向石灰水中通入过量CO2 | |
| B. | 向Fe(OH)3胶体中逐滴加入过量H2SO4溶液 | |
| C. | 足量NaOH溶液中逐滴加入Al2(SO4)3溶液 | |
| D. | 向NaAlO2溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目: 来源: 题型:选择题
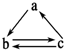 下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )| 物质 选项 | a | b | c |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | C | CO | CO2 |
| C | Fe | FeCl2 | FeCl3 |
| D | CuO | Cu(OH)2 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 9:4 | B. | 6:1 | C. | 7:6 | D. | 11:6 |
查看答案和解析>>
科目: 来源: 题型:解答题
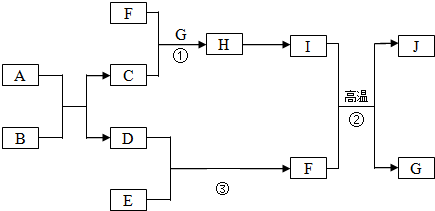
 ,B的名称是盐酸或硫酸.
,B的名称是盐酸或硫酸.查看答案和解析>>
科目: 来源: 题型:解答题
 化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | |
| B. | 按照规定对生活废弃物进行分类放置 | |
| C. | 经常使用一次性筷子、纸杯、塑料袋等 | |
| D. | 改进汽车尾气净化技术,减少大气污染物的排放 |
查看答案和解析>>
科目: 来源: 题型:填空题
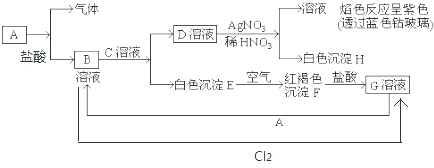
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com