
科目: 来源: 题型:选择题
| A. | 56克亚铁离子得到2NA个电子被还原成单质 | |
| B. | 1L 1mol/L的KCl溶液中含Cl-的物质的量为NA | |
| C. | 在25℃、1.01×105Pa的条件下,2.24LCO2中含有的原子数大于0.3NA | |
| D. | 0.1mol/L的氯化钡溶液中氯离子的数目是0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
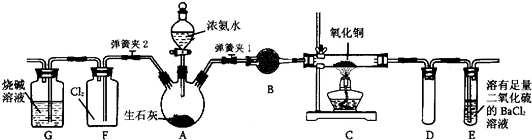
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质硅是将太阳能转化为电能的常用材料 | |
| B. | 大气中SO2是形成酸雨的主要因素之一 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | “血液透析”利用了胶体的性质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | Na+2H2O═Na++2OH-+H2↑ | ||
| C. | 2Fe+6H+═Fe3++3H2↑ | D. | NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢化物的沸点Y>R>X | B. | 含氧酸酸性R>X | ||
| C. | X、Y不可能共存于离子化合物中 | D. | 原子半径Z>R>X>Y |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 焰火中呈现的绚丽色彩,是各种金属元素焰色反应形成的 | |
| B. | 小苏打既是制作糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰 | |
| D. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 |
查看答案和解析>>
科目: 来源: 题型:解答题
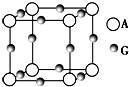 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 离子晶体 | 原子晶体 | 分子晶体 |
| A | NaOH | Ar | SO2 |
| B | K2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 | 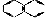 |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com