
科目: 来源: 题型:选择题
| A. | H2O | B. | Na2O2 | C. | KClO3 | D. | KMnO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
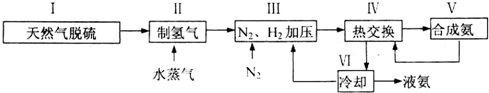
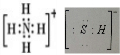 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.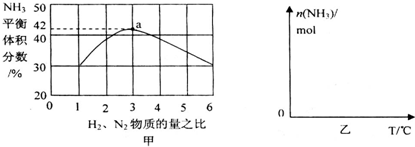
查看答案和解析>>
科目: 来源: 题型:解答题
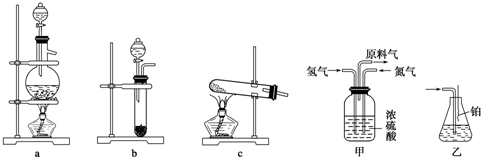
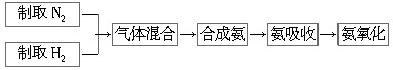
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C(s)+H2O(g)?CO(g)+H2(g) 加入大量C固体,V正 增大,V逆 减小 | |
| B. | Zn(s)+HCl(aq)═ZnCl2(aq)+H2(g),使用纯锌比粗锌反应速率快 | |
| C. | 对于反应H2(g)+I2(g)?2HI(g),恒温恒容充入Ne,容器内压强增大,V正、V逆 均增大 | |
| D. | 对于反应2SO2(g)+O2(g)═2SO3(g)当升高温度V正、V逆 都加快 |
查看答案和解析>>
科目: 来源: 题型:解答题
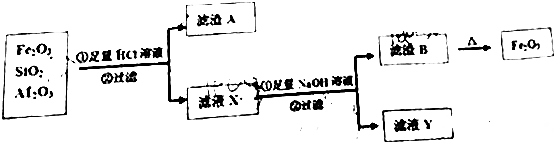
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4Cl溶液,NaOH溶液 | B. | 浓NaOH溶液,NH4Cl晶体,浓H2SO4 | ||
| C. | 浓氨水,浓硫酸 | D. | NH4Cl固体,消石灰,碱石灰 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H5Br和NaOH溶液混合共热 | |
| B. | 乙醇和NaOH溶液混合共热 | |
| C. | 一溴丁烷与的NaOH的丁醇溶液混合共热 | |
| D. | 氯苯与NaOH溶液混合共热 |
查看答案和解析>>
科目: 来源: 题型:解答题
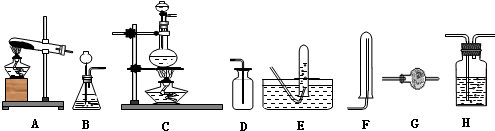
| 制取气体 | 杂质气体 | 制取气体的发生装置 | 除去杂质气体的净化装置 | 收集装置 | 净化装置内 所用试剂 | 检验制得气体所用试剂 |
| NH3 | H2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com