8.铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用.
I.氧化物-Fe
2O
3:用工业FeCl
3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
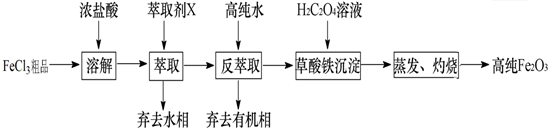
已知:HCl(浓)+FeCl
3?HFeCl
4.试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①Ca
2+、Mn
2+、Cu
2+等杂质离子主要在水(填“水”或“有机”)相.
②若实验时共用萃取剂X 150mL,萃取率最高的方法是c(填字母).
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是FeCl
3(写化学式);反萃取能发生的原因是加高纯水时,酸度[或c(H
+)]降低,HCl(浓)+FeCl
3?HFeCl
4平衡向转化为FeCl
3的方向移动.
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是减少草酸铁晶体的溶解损耗.
(4)测定产品中铁的含量需经酸溶、还原为Fe
2+,然后在酸性条件下用标准K
2Cr
2O
7溶液滴定,已知铬的还原产物为Cr
3+,写出该滴定反应的离子方程式6Fe
2++Cr
2O
72-+14H
+=6Fe
3++2Cr
3++7H
2O.
II.含氧酸盐-铁酸铜(CuFe
2O
4)是很有前景的热化学分解水制氢的材料,CuFe
2O
4在制氢过程中可以循环使用.在热化学循环分解水制氢的过程中,铁酸铜(CuFe
2O
4)先要煅烧成氧缺位体(CuFe
2O
4-a),氧缺位值(a)越大,活性越高,制氢越容易.
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式CuFe
2O
4-a+aH
2O=CuFe
2O
4+aH
2↑.
(6)课外小组将铁酸铜样品在N
2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=0.51.(结果保留小数点后2位)

 .
.