
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
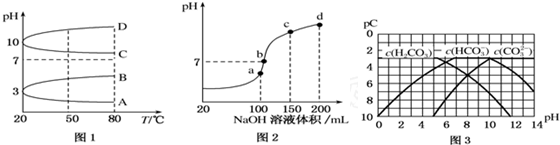
查看答案和解析>>
科目: 来源: 题型:解答题
 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉 | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com