
科目: 来源: 题型:选择题
| A. | 还原性:HF<HCl<H2S | B. | 金属性:Na>Mg>Be | ||
| C. | 非金属性:F>Cl>S | D. | 离子半径:Al3+>Mg2+>F- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将苯和硝酸混和,再加入浓硫酸,冷却 | |
| B. | 先加苯,再加浓硫酸,最后加入浓硝酸 | |
| C. | 在浓硝酸中加入浓硫酸,冷却后加入苯 | |
| D. | 在浓硫酸中加入浓硝酸,冷却后加入苯 |
查看答案和解析>>
科目: 来源: 题型:解答题
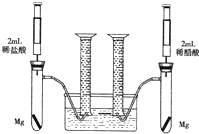 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
科目: 来源: 题型:解答题
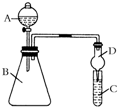 某同学为验证元素周期表中元素性质的递变规律,利用如图装置可验证同主族非金属性的变化规律.设计了如下系列实验.
某同学为验证元素周期表中元素性质的递变规律,利用如图装置可验证同主族非金属性的变化规律.设计了如下系列实验.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
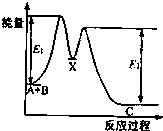 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )| A. | E2表示反应X→C的反应热 | |
| B. | A+B→C此反应放热 | |
| C. | X是反应A+B→C的催化剂 | |
| D. | 加入催化剂可改变反应A+B→C的反应热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 没有氧元素参加的反应一定不是氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H+) | |
| B. | 使红色布条褪色(HCl) | |
| C. | 使淀粉KI试纸变蓝(Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com