
科目: 来源: 题型:选择题
| A. | Mg2C3水解生成C3H4 | B. | Li2C2水解生成C2H4 | ||
| C. | Al4C3水解生成C3H4 | D. | ZnC2水解生成C2H |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤⑥ | C. | ②③④⑥ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增大压强,单位体积活化分子数一定增加,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增加,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,一定降低了反应的活化能,化学反应速率一定增大 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
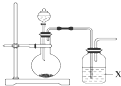 实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示
实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com