
科目: 来源: 题型:选择题
| A. | 氯化钠 | B. | 氯化钾 | C. | 氯化铜 | D. | 氯化铝 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 向氯水中滴加NaHCO3,有气泡产生,说明氯水中含有HCl和HClO | |
| B. | 向FeCl2溶液中滴加氯水,溶液变成棕黄色,说明氯水中含有HClO | |
| C. | 氯水呈浅黄绿色,说明氯水中含有Cl2 | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | A | B | C | D |
| 物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
| 代表物质 | NaCl | 金刚石 | 干冰 | Ne |
| 组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
| 结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
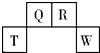 短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )| A. | R的氢化物可以既有极性键又有非极性键 | |
| B. | 常温下丁的浓溶液可用T单质所制的容器来盛装 | |
| C. | 丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体 | |
| D. | 甲、乙、丙、丁受热均易分解 |
查看答案和解析>>
科目: 来源: 题型:填空题
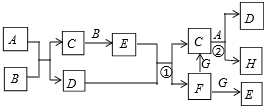 下列有关物质的转化关系如图所示(部分物质与条件已略去,其中反应②的条件是“700℃,催化剂”).G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体.请回答下列问题:
下列有关物质的转化关系如图所示(部分物质与条件已略去,其中反应②的条件是“700℃,催化剂”).G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体.请回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:解答题
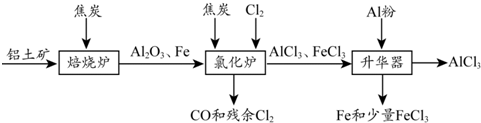
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
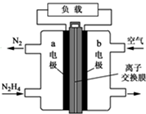 肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:
肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
 X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )
X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | E与G的原子序数相差25 | |
| B. | 常温下,X和Y的单质均能与水剧烈反应 | |
| C. | TE2的熔点高于ZE2晶体 | |
| D. | E、T、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com