
科目: 来源: 题型:选择题
| A. | CH4 C2H4 | B. | CH4 C3H4 | C. | C2H4 C3H4 | D. | C2H2 C3H6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+ )=c(X-)>c(OH-)=c(H+) | |
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3NA | |
| C. | 0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2L 四氯化碳所含分子数为0.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应热就是反应中放出的能 | |
| B. | 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | 由C(s,石墨)=C(s,金刚石),△H=1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧燃电池在碱性介质中负极的反应式是:O2+2H2O+4e-=4OH- | |
| B. | NaHCO3在水溶液中的水解离子方程式:HCO3-+H2O?CO2↑+OH- | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+ (aq) | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目: 来源: 题型:解答题
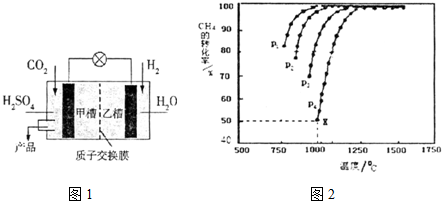 第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.查看答案和解析>>
科目: 来源: 题型:解答题
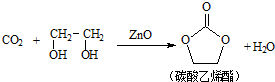
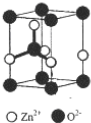
查看答案和解析>>
科目: 来源: 题型:多选题
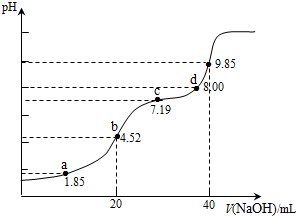
| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c($HS{{{O}_{3}}^{-}}_{\;}$) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 原子半径由大到小的顺序:X、Y、Z、W | |
| B. | 元素最高正价由低到高的顺序:X、Y、Z、W | |
| C. | 简单氢化物的热稳定性由弱到强的顺序:Y、Z、W | |
| D. | 最高价氧化物的水化物的酸性由弱到强的顺序:X、Y、Z |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com