
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 1 | ||||||||
| 2 | A | |||||||
| 3 | B | C | D | E |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=4的NaHSO3溶液中:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>C(OH-) | |
| B. | 0.2mol•L-1Na2CO3溶液和0.1mol•L-1盐酸等体积混合,在混合溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 等体积、等浓度的HR溶液和NaOH溶液混合,溶液中一定存在:c(Na+)>c(R-)>c(OH-)>c(H+) | |
| D. | 等体积、等浓度的①CH3COONa②NaNO3③NaClO溶液中离子总数:②>①>③ |
查看答案和解析>>
科目: 来源: 题型:选择题
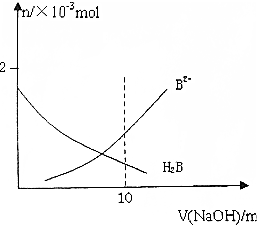 常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )| A. | 当V(NaOH)=10mL时,溶液中有关粒子浓度大小关系为:c(Na+)>c(B2-)>c(HB-)>c(H2B)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2B溶液混合后其溶液中,水的电离程度被促进 | |
| C. | 向NaHB溶液中加水稀释,溶液中c(Na+),c(B2-),c(HB-),c(OH-)均减小 | |
| D. | 当V(NaOH)=10mL时,溶液中存在下列关系c(H2B)+c(H+)=c(OH-)+c(B2-) |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠着火时,用细沙覆盖灭火,镁着火用泡沫灭火器 | |
| B. | 用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则待测结果会偏低 | |
| C. | 测定一包白色粉末的质量,将药品放在右盘,砝码放在左盘 | |
| D. | 除去乙醇中的乙酸可先加入碳酸钠溶液然后蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO | |
| B. | BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO | |
| C. | Be(OH)2只能溶于盐酸,不能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
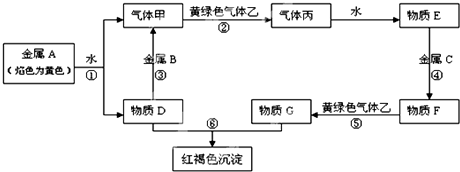
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com