
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,11.2L CO2与8.5g NH3所含分子数相等 | |
| B. | 等质量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 同温同压下,相同体积的H2和CO2的原子数之比为2:3 | |
| D. | 同温同压下,相同质量的NO和C2H4(气体)体积相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
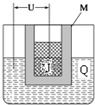 已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答:
已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答: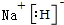
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该电池放电时,正极的电极反应为O2+4H++4e-═2H2O | |
| B. | 该电池充电时,阴极发生了氧化反应:Li++e-═Li | |
| C. | 电池中的有机电解液可以用稀盐酸代替 | |
| D. | 正极区产生的LiOH可回收利用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Li为电池的负极 | |
| B. | 充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 | |
| C. | 电池的电解液可用LiCl水溶液代替 | |
| D. | 放电时电子从负极经外电路流向正极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,11.2LO2所含的原子数为1.5NA | |
| B. | 常温常压下,18gH2O所含的原子数为NA | |
| C. | 标准状况下,16gO2所含的电子数为8NA | |
| D. | 标准状况下,11.2L氢气和氦气的混合气体所含的原子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
查看答案和解析>>
科目: 来源: 题型:解答题
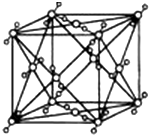 已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目: 来源: 题型:解答题
 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目: 来源: 题型:解答题
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com