
科目: 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,把上层液体从分液漏斗上口倒出 | |
| C. | 不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭 | |
| D. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体放入烧杯中溶解 |
查看答案和解析>>
科目: 来源: 题型:解答题
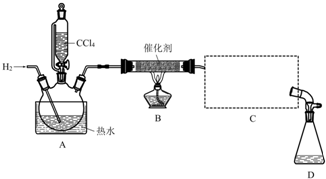
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
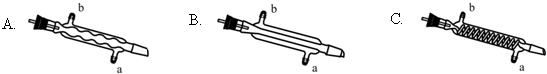
查看答案和解析>>
科目: 来源: 题型:解答题
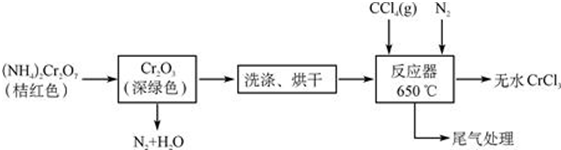
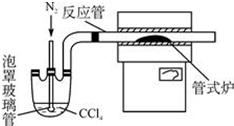
查看答案和解析>>
科目: 来源: 题型:解答题
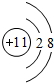 ,B在元素周期表的位置第二周期IVA族;
,B在元素周期表的位置第二周期IVA族; ;
;查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 将1mol•L-1 NaAlO2溶液和1.5mol•L-1的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO4-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 配制该溶液时,将FeBr2粉末溶解在HBr溶液中,并加入少量铁钉 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.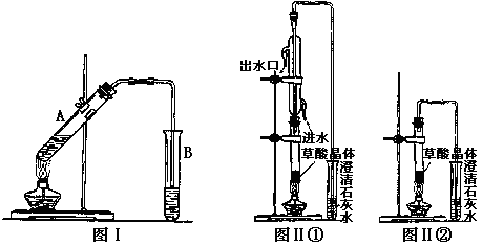
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 1L0.1mol•L-1 CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 常温下,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时:c(NH4+)=2c(SO42-) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH值为1的溶液 Fe3+、NH4+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液 Fe2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13 mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com