
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S2- | B. | S | C. | SO32- | D. | SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 醋酸溶液与NaOH反应:OH-+H+→H2O | |
| B. | 硝酸溶液和碳酸氢钠反应:H++2CO32-→CO2↑+H2O | |
| C. | 将溴水加入KI溶液中:Br2+2I-→I2+2Br- | |
| D. | CO2通入澄清石灰水:2OH-+CO2→H2O+CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化剂和还原剂都是KMnO4 | |
| B. | 该反应的还原产物只有MnO2 | |
| C. | 该反应的氧化产物是O2 | |
| D. | KMnO4中Mn元素表现氧化性,O元素表现还原性 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
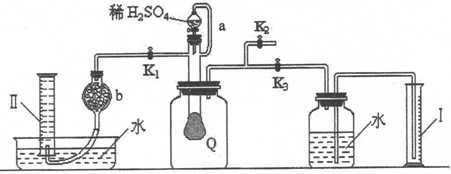
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 上述反应中氧化产物只有N2 | |
| B. | 当有0.4molCO2生成时,反应中转移的电子的总数目约为1.204×1024 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.02mg/L的废水,至少需用4.0×10-5molCl2处理后才符合排放标准 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲、乙、丙溶液中溶质的质量分数均大于5% | |
| B. | 甲溶液中溶质的质量分数小于5%,乙、丙溶液中溶质的质量分数大于5% | |
| C. | 甲溶液中溶质的质量分数小于5%,乙的大于5%,丙的等于5% | |
| D. | 甲、乙、丙溶液中溶质的质量分数均等于5% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 9.6g | B. | 6g | C. | 4.8g | D. | 2.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com