
科目: 来源: 题型:选择题
| A. | 在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1是指1秒钟时某物质的浓度为0.8 mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 化学反应的速率可以是g•(L•s)-1,也可以是kg•(L•s)-1,甚至可以用t•(L•s)-1表示 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶质的质量分数为ω=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c (OH-)=$\frac{b}{V}$mol•L-1 | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目: 来源: 题型:选择题
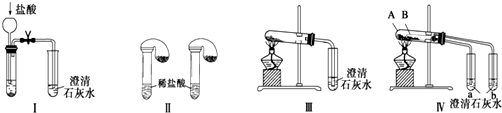
| A. | 根据图Ⅰ所示实验,可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体 | |
| B. | 在图Ⅱ所示实验的左右两只试管中加入足量的盐酸,然后向两个气球中分别加入等物质的量的碳酸钠和碳酸氢钠固体,根据反应后气球的大小可鉴别两种固体 | |
| C. | 与实验Ⅲ相比,实验Ⅳ的突出优点是可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 | |
| D. | 若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠 |
查看答案和解析>>
科目: 来源: 题型:解答题
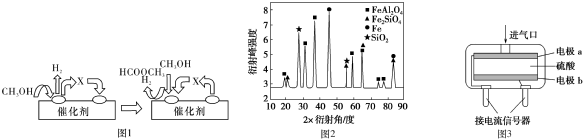
查看答案和解析>>
科目: 来源: 题型:解答题
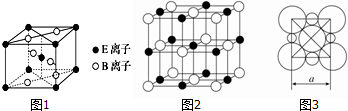
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高温下Fe与水蒸气反应可生成Fe3O4和H2 | |
| B. | Cu与冷的浓硫酸因发生钝化,反应难以进行 | |
| C. | Na2O、Na2O2与CO2反应,产物均相同 | |
| D. | 向AlCl3溶液中逐滴加氨水,产生白色沉淀,过量时,沉淀消失 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,22.4L N2含有的分子数为NA | |
| B. | 1mol•L-1 Al2(SO4)3溶液中含SO42-数目为3NA | |
| C. | 常温常压下,46g NO2含有氧原子数为2NA | |
| D. | 1mol Fe在足量Cl2中燃烧,转移电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:解答题

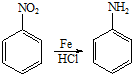
 +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$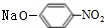 +NaCl+H2O.
+NaCl+H2O.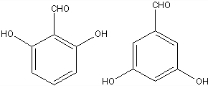 、
、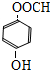 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数少 | |
| B. | 酸性:HXO4>HYO4 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A | 向淀粉KI溶液中滴加硫酸氢钠溶液 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 将氯水滴加到含KSCN溶液的绿矾溶液中 | 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl-, Fe3++3SCN-═Fe(SCN)3 |
| C | 向硫化钠和亚硫酸钠的混合液中滴加稀盐酸 | 产生淡黄色沉淀 | 2S2-+SO32-+6H+═3S↓+3H2O |
| D | 向含酚酞的氢氧化钡溶液中滴加稀硫酸 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com